编辑:Yuna
医脉通整理,未经授权请勿转载。
大多数SCLC患者最初对化疗有应答,但大多数患者一线治疗后会复发,且仅约10%患者在2年后为无病状态。
生物学特性、基因组特征
SCLC是一种与副肿瘤综合征相关的神经内分泌癌,特征是快速增殖和早期转移。2012年至2015年期间,3项具有里程碑意义的测序研究为SCLC的基因组特征进行了深入解析。这些研究证实,SCLC中2个关键肿瘤抑制基因几乎呈现双等位基因的失活:约75%~90%肿瘤中的TP53 和约60%~90%肿瘤中的RB1。组蛋白乙酰转移酶基因CREBBP和EP300基因的失活也可能在SCLC中发挥一定作用。此外,也有研究报道了SCLC中NOTCH家族基因和TP73和RLF-MYCL1融合等变异。除了体细胞突变,SCLC中也发现了所有MYC家族成员的扩增(16%)、FGFR1(6%)扩增和SOX2(27%)扩增。
转录组学及分类
自1960年代以来,研究者尝试根据组织学特征和免疫组织化学研究将SCLC分型。最初,研究者根据神经内分泌蛋白不同表达导致的经典和变异原发性进行分组。后续研究将其重新分类为ASCL1- high(高表达)和NEUROD1- high。而基于最新分型的研究,目前SCLC的分类由4种关键转录调节因子的表达定义:ASCL1-high(SCLC-A)、NEUROD1-high(SCLC-N)、POU2F3-high(SCLC-P)和 YAP1-high(SCLC-Y)。
免疫学特征和可能机制
免疫抑制微环境对SCLC的发病机制尤其重要(图 1)。高突变负荷和副肿瘤综合征的存在提示SCLC可能是一种免疫原性肿瘤,肿瘤浸润淋巴细胞(TIL)水平、肿瘤细胞CD8/CD3 比率和主要组织相容性复合体I类和II类抗原表达显著降低。肿瘤相关巨噬细胞也促进 SCLC肿瘤的免疫抑制微环境。免疫检查点抑制性蛋白(PD-L1、T细胞免疫球蛋白和粘蛋白结构域分子3 [TIM3]、淋巴细胞激活基因 [LAG3]等)可能在TILs中上调。此外,TILs上的PD-L1、PD-L2、TIM3、LAG3表达也与SCLC预后改善相关。
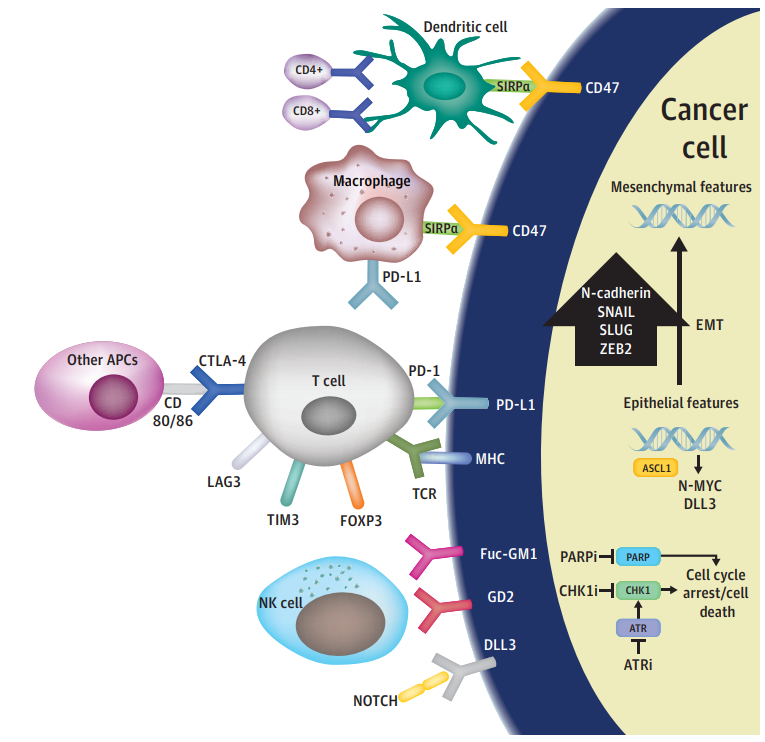
图1 SCLC的可能发病机制
LS-SCLC 的一线疗法
对于LS-SCLC患者,治疗方法有全身性治疗和RT(包括预防性颅脑照射[PCI])。依托泊苷+铂类仍然是最常用的初始方案(表 1)。化疗中加入放疗可提高LS-SCLC患者的生存率和局部控制,尤其在早期疾病阶段。
表1 LS-SCLC的一线治疗策略进展
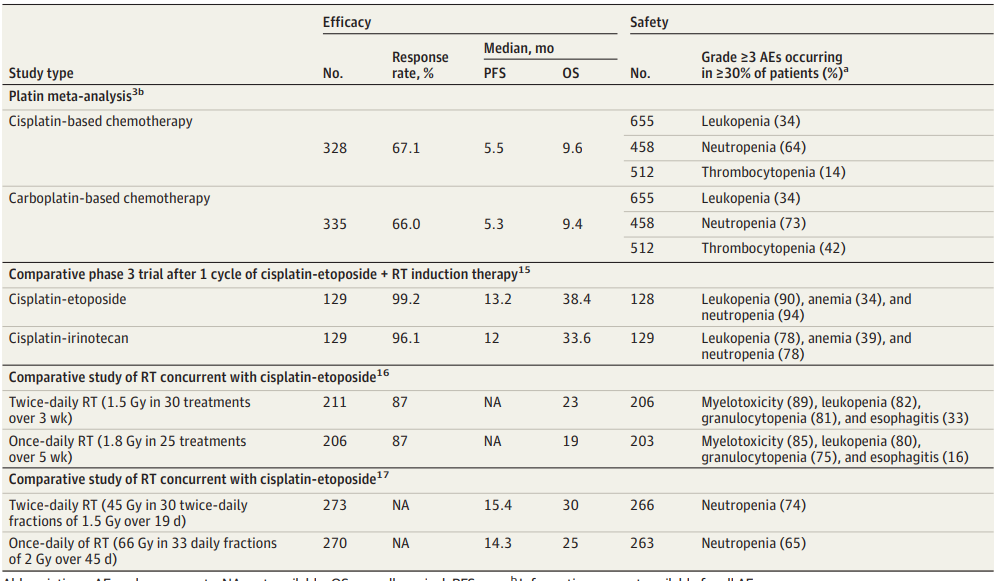
与依托泊苷+
ES-SCLC 的一线疗法
含铂化疗是ES-SCLC的传统标准一线疗法,依托泊苷+铂类最为常用。巩固性胸部放疗可能会降低胸腔内复发风险并促进免疫反应。3期CREST 试验表明,一线化疗序贯胸部放疗与2年生存率改善相关,尤其是在低负荷转移性ES-SCLC 患者中。2期RTOG 0937研究证明,1年时进行 PCI+巩固RT不同步化疗可延缓疾病进展,但不改善OS。正在进行的2/3期 LU007研究正在评估巩固放疗+标准一线化疗+免疫治疗的疗效。2007年,欧洲开展的一项随机试验发现PCI可降低脑转移风险并带来较小的生存改善。最近在日本开展的一项研究建议,密切磁共振成像检测可作为PCI的可替代方案,具有相似的生存率和更好的生活质量。
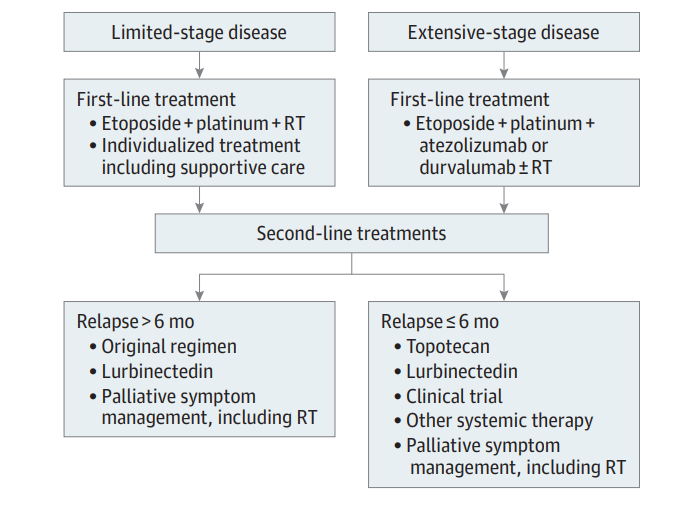
图2 SCLC的治疗策略
基于IMpower133、CASPIAN研究、ASTRUM-005研究,以及2种PD-L1单抗
一项IMpower133、CASPIAN、KEYNOTE-604和ECOG-ACRIN EA5161的Meta分析显示,在所有1553例患者中,化疗中加入PD-1和PD-L1单抗,生存率显著提高了24%(HR=0.76,P<0.001)。
研究显示,放疗可启动免疫系统并增强免疫检查点抑制剂联合治疗的疗效。CASPIAN研究和IMpower133纳入中枢神经系统(CNS)转移患者情况不同,结果也不同。放疗对SCLC 的潜在远隔影响仍在探索和研究中。
后续治疗选择
大多数复发SCLC患者需要后续治疗,一线治疗后不到3个月出现复发的患者被认为是难治性疾病,通常不予以与一线治疗相同的方案。一线治疗后超过6个月复发患者被认为是化疗敏感患者,可继续采用相同方案。2012年发表的一项关于21项研究的系统分析显示,一线治疗耐药或难治性(复发<3个月)患者对二线治疗的应答较低,敏感患者、耐药或难治性患者的客观缓解率(ORR)分别为27.7%和14.8%。相当一部分患者在6个月内死亡,中位OS为6.7 个月,敏感患者、耐药或难治性患者的中位OS分别为7.7个月和5.5个月。
拓扑替康是常用的SCLC二线药物。研究显示,拓扑替康显示出与
Lurbinectedin 是一种选择性致癌基因转录抑制剂,基于一项2期篮式研究(其中43% SCLC患者为难治性),于2020年获FDA批准用于转移性SCLC的二线治疗。中位随访17.1个月时,总体ORR为35.2%,敏感患者的ORR为45%(无化疗间期[CTFI]为90 天),难治性患者的ORR为 22%(CTFI <90天,其中21例难治性患者的CTFI <30 天)。所有患者的中位 OS 为 9.3 个月,敏感患者和难治性患者的中位OS为11.9个月和5.0个月。CTFI≥180天患者的中位OS为16.2个月。2022年ASCO大会上,中国研究者公布了lurbinectedin单药用于中国患者二线治疗的I期研究,也取得了初步良好结果。
3 期ATLANTIS试验中,lurbinectedin联合阿霉素对比托泊替康或CAV未改善患者中位OS(8.6个月 vs 7.6 个月,HR=0.97),可改善PFS(HR=0.81,P=0.04)。1b/2 期研究显示,lurbinectedin+
对于SCLC后续治疗的其他选择,最新NCCN指南推荐的方案包括化疗(CAV、紫杉醇、多西他赛、伊立替康、
新型疗法
目前,研究者正在开发多种药物治疗SCLC患者(表 2)。包括极光激酶A抑制剂、PRAP抑制剂、
表2 正在研发的新药物
结语
SCLC仍是一种难治性癌症,OS改善仍然较有限,近期开展的相关研究加深了我们对SCLC免疫微环境的理解,并揭示了不同的SCLC分子模式,为潜在的新疗法提供了新思路。一线免疫疗法、近两年lurbinectedin用于后续治疗的获批以及正在进行的大量研究,正在改变着SCLC的治疗前景,有望进一步改善SCLC患者的OS。更多研究继续专注于与治疗应答和新靶点相关的生物标志物以期进一步改善SCLC患者的预后。
参考文献
[1] Petty WJ, Paz-Ares L. Emerging Strategies for the Treatment of Small Cell Lung Cancer: A Review. JAMA Oncol. 2022 Dec 15. doi: 10.1001/jamaoncol.2022.5631. Epub ahead of print. PMID: 36520421.
[2] Reguart N, Marin E, Remon J, Reyes R, Teixido C. In search of the long-desired ‘copernican therapeutic revolution’ in small-cell lung cancer. Drugs. 2020;80(3):241-262. doi:10.1007/s40265- 019-01240-8
[3] Reck M, Vicente D, Ciuleanu T, et al. Efficacy and safety of nivolumab (nivo) monotherapy versus chemotherapy (chemo) in recurrent
[4] Horn L, Mansfield AS, Szczęsna A, et al; IMpower133 Study Group. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med. 2018;379(23):2220-2229. doi:10.1056/NEJMoa1809064
[5] Cheng Y, Han L, Wu L, et al.ASTRUM-005 Study Group. Effect of First-Line Serplulimab vs Placebo Added to Chemotherapy on Survival in Patients With Extensive-Stage Small Cell Lung Cancer: The ASTRUM-005 Randomized Clinical Trial. JAMA. 2022 Sep 27;328(12):1223-1232. doi: 10.1001/jama.2022.16464. PMID: 36166026; PMCID: PMC9516323.
[6] Faivre-Finn C, Snee M, Ashcroft L, et al; CONVERT Study Team. Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer (CONVERT): an open-label, phase 3, randomised, superiority trial. Lancet Oncol. 2017;18(8):1116-1125. doi:10.1016/S1470-2045(17)30318-2
[7] Peifer M, Fernández-Cuesta L, Sos ML, et al. Integrative genome analyses identify key somatic driver mutations of small-cell lung cancer. Nat Genet. 2012;44(10):1104-1110. doi:10.1038/ng.2396
[8] Facchinetti F, Di Maio M, Tiseo M. Adding PD-1/PD-L1 inhibitors to chemotherapy for the first-line treatment of extensive stage small cell lung cancer (SCLC): a meta-analysis of randomized trials. Cancers (Basel). 2020;12(9):E2645. doi:10.3390/cancers12092645
[9] NCCN Guidelines Version 3.2023 Small Cell Lung Cancer.
 肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!
肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!  肺段与肺内管道应用解剖
肺段与肺内管道应用解剖  肺转移瘤的十种不典型CT表现
肺转移瘤的十种不典型CT表现  肺内淋巴结的CT表现特点及与病理对照
肺内淋巴结的CT表现特点及与病理对照  肺实变与肺不张的CT鉴别诊断
肺实变与肺不张的CT鉴别诊断  新冠肺炎典型影像学诊断与鉴别诊断
新冠肺炎典型影像学诊断与鉴别诊断  肺部分叶和分段影像解剖
肺部分叶和分段影像解剖  肺磨玻璃密度阴影GGO 的CT诊断与处理
肺磨玻璃密度阴影GGO 的CT诊断与处理  “院长要求医生给所有病人开中药”?当地通报:停
“院长要求医生给所有病人开中药”?当地通报:停  又是一年毕业季,王辰院士寄语医学毕业生这八个字
又是一年毕业季,王辰院士寄语医学毕业生这八个字  面对DRG,临床医生与科室该怎么办?
面对DRG,临床医生与科室该怎么办?  医生:讨厌没有边界感的病人
医生:讨厌没有边界感的病人  当心!医务人员添加医患微信(群)有六大风险……
当心!医务人员添加医患微信(群)有六大风险……  我去急诊插管,另一位手术患者竟然要投诉我……
我去急诊插管,另一位手术患者竟然要投诉我……  医学生培养了八年为何还不会看病?灵魂反问:他们
医学生培养了八年为何还不会看病?灵魂反问:他们  58岁医生猝然离世!来自一位同行的呼吁:请给医生减
58岁医生猝然离世!来自一位同行的呼吁:请给医生减