编辑:Yuna
医脉通整理,未经授权请勿转载。
2022年末年终巨献,广东省人民医院
专家简介

吴一龙 教授
肿瘤学教授,博士生导师
IASLC杰出科学奖获得者
广东省医师协会(GDMDA)会长
广东省人民医院(GDPH)首席专家
广东省肺癌研究所(GLCI)名誉所长
中国胸部肿瘤研究协作组(CTONG)主席
2018-2022年临床医学领域全球高被引科学家
中国临床肿瘤学会前任理事长,现指导委员会主任委员
回眸2021年
回眸2021年,在吴一龙教授的“龙哥江湖”里,抗肿瘤治疗领域最厉害的武器当属靶向辅助治疗、辅助免疫治疗和抗体偶联药物(ADC)。2022年伊始,国际上建立起晚期
免疫治疗研究主要分为纳入非鳞癌、鳞癌和不论组织学类型NSCLC患者。从多项研究数据可见,免疫疗法的无进展生存期(PFS)约8-11个月,总生存期(OS)约24~26个月。JTO杂志近期发表的一篇评述认为多种PD-L1/PD-1 药物构成了“海啸”,但没有一个药物能突破目前的瓶颈而成为千禧之子。
转化研究那一抹曙光
Douglas Hanahan教授年初在Cancer Discovery发表的最新综述指出了癌细胞最新的四个特征:解锁表型可塑性(unlocking phenotypic plasticity)、衰老细胞(senescent cells)、非突变表观遗传重编码(nonmutational epigenetic reprogramming)、多态微生物组(polymorphic microbiomes)。
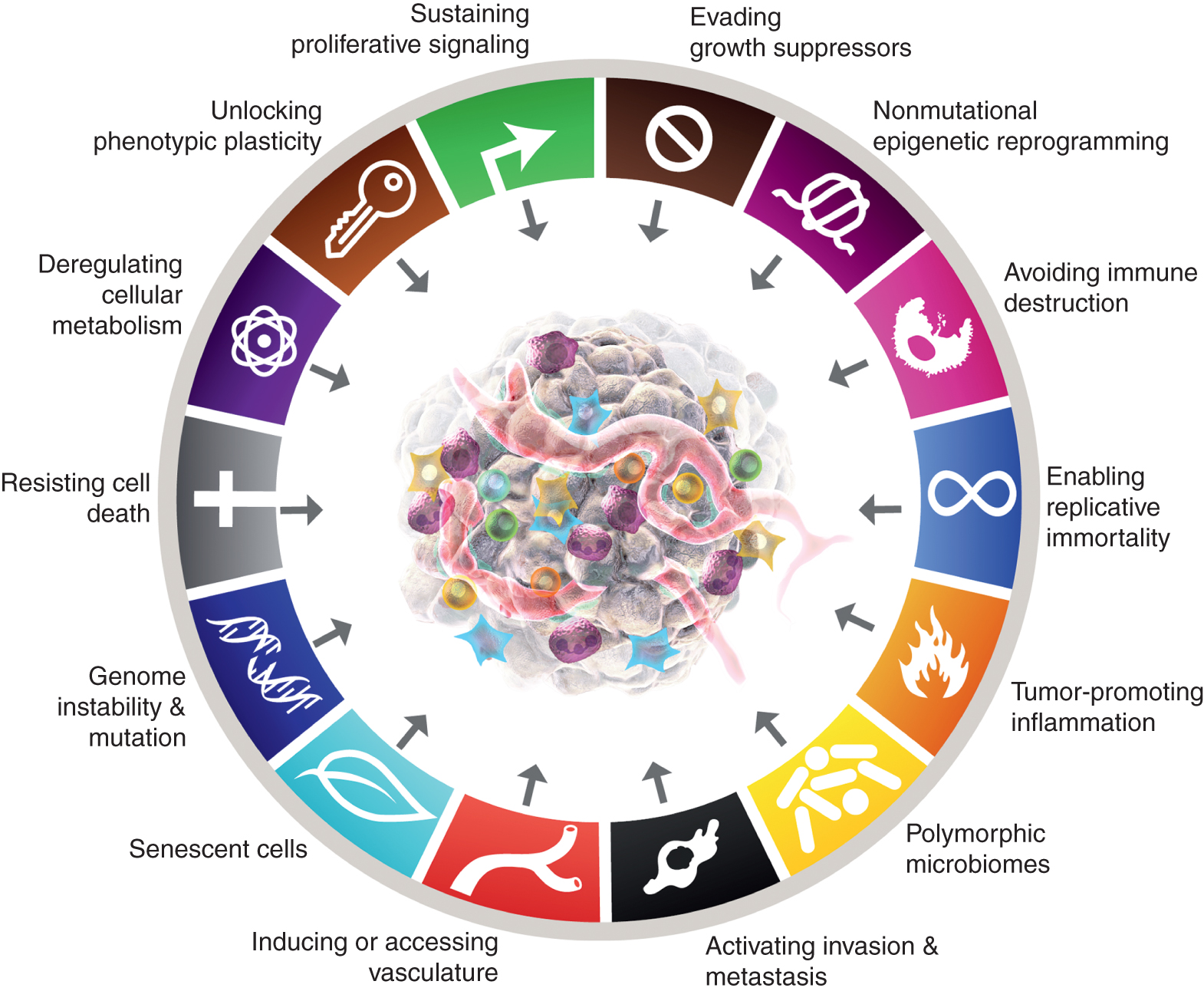
解锁表型可塑性:细胞分化是正常细胞的重要标志,表型可塑性可以破坏细胞分化,解锁这种破坏细胞分化的能力,这将成为新的抗肿瘤的思路。
衰老细胞:长期以来,细胞衰老被认为是一种抗肿瘤保护机制,癌细胞因此被诱导经历衰老。但更多证据提示,衰老细胞可能影响了肿瘤微环境,并可能通过各类机制,在某些情况下刺激肿瘤发展。
非突变表观遗传重编码:指的是DNA序列结构没有改变但功能产生改变,但基因功能发生了可遗传的调控改变。这提示未来的研究更多地会从功能学上进行研究,这几乎完全拓宽了研究的思路。
多态微生物组:存在于肠道或连接器或肿瘤自身的微生物组,是影响微环境的重要因素。
吴一龙教授指出,未来5-10年可能会在癌细胞新特征领域拓展出新的治疗理念。“癌细胞新特征”是2022年度非常重磅的进展,引用率非常高,从中可预见未来抗肿瘤治疗的发展方向。
分子残留病变(MRD):定义可能被治愈的肺癌术后患者
吴一龙教授团队2022年7月在Caner discovery杂志发表的研究认为,MRD可能可定义被治愈的肺癌术后患者。观察近两年结果显示,不论分期如何,大部分MRD阴性患者(96.8%)不复发。这意味着,给予MRD阴性(I-III期)患者辅助治疗起不到治疗的作用或效果,这引领了抗肿瘤治疗“做减法”的潮流。吴一龙教授指出,临床上需要将无效的方法“减掉”,让患者活得更好,得到真正需要的治疗。
无独有偶,北京大学人民医院近日发表在BMC Medcine杂志的一项Meta分析纳入6项研究,结果显示,MRD阳性是疾病复发的有力预测因子(HR=4.95,P<0.001),OS较差(HR=3.93,P<0.001)。辅助治疗仅可为MRD阳性患者带来RFS获益(HR=0.27)。
吴一龙教授指出,MRD持续阴性肺癌术后患者可能被治愈,而MRD阳性患者需要治疗,但目前的治疗方案仍未知。目前,有多项MRD指导的研究正在开展中,预计3-5年这些研究结果将进一步见证MRD的价值。
2022年改变临床实践的研究
2022年是NMPA和FDA批准肺癌新药最多的一年。
早期NSCLC—— CheckMate-816
3月4日,FDA基于 CheckMate-816批准了新辅助
后续开展的NADIM II研究最大的不同之处是(IIIA-IIIB期)新辅助+手术后,加入了辅助免疫治疗。从研究数据可见,不论治疗方案如何,只要患者能达到pCR,生存更好。
吴一龙教授介绍了目前正在开展的CTONG1804研究:旨在探索PD-L1表达水平指导的新辅助免疫±化疗用于可切除患者的疗效,该研究在2022年ESMO IO大会公布并引起业界较大关注。与既往研究不同之处在于:第一,对于PD-L1≥50%患者,头对头比较了免疫vs免疫+化疗的疗效。第二,将MRD结合其中。结果显示,新辅助治疗前MRD阳性率高达89.5%,新辅助治疗之后,MRD阳性率将至34.2%,术后MRD阳性率为27.6%,新辅助治疗在各治疗阶段发挥了重要作用。
KEYNOTE-091被纳入ESMO每季度举办虚拟全体大会上。该研究评估
从两项“辅助治疗”关键研究可见,IMpower010研究(
而目前围手术期有多项研究正在开展中,多项研究共性之处在于:4周期新辅助治疗+手术+1年辅助治疗,而没有采用成功CheckMate-816研究的3个周期新辅助治疗。正如KEYNOTE-091专家讨论,吴一龙教授指出,围手术期免疫治疗还有包括PD-L1表达水平、生存终点等太多问题没有解决。基于CheckMate-816和KEYNOTE-091这两项关键研究,2022年9月在JTO杂志发表的一篇关键评述探讨了患者需要一个没有疾病的长生存(DFS)还是需要一个带病的长生存(OS)。专家组最终认为,辅助治疗的临床决策和新药注册都应使用DFS作为最相关的主要终点。
局部晚期NSCLC——GEMSTONE-301
GEMSTONE-301研究填补不可手术III期肺癌患者序贯放化疗后免疫治疗的空白。PACIFIC、PACIFIC-R、GENSTONE-301研究显示,III期患者放化疗序贯免疫治疗的3年OS率为56%~59%。这三项研究提示,同步/序贯放化疗后免疫治疗都是标准治疗。
III期患者异质性强,在可手术的IIIA-N2和不可手术的IIIA-N2期患者0之间有“灰色区域”。不能切除患者是否能“转化”为可手术患者是值得探讨的话题,SHR-1701-205研究、APPROACH/CTONG2101研究正在进行相关探索。
SHR-1701-205研究(入选2022 ESMO IO大会口头报告)旨在评估一种双特异性抗体SHR-1701±化疗新辅助治疗序贯手术或放疗用于III期不切除NSCLC的疗效。该研究纳入不可手术III期NSCLC患者,按PD-L1 TPS分层,给予患者新辅助治疗3个周期,后续经MDT讨论后,不可手术患者给予放化疗序贯SHR-1701,可手术患者给予手术序贯SHR-1701。研究显示,加入诱导免疫治疗后,可提高有效率14%。更重要的是,外科转化率为25.2%——经诱导治疗后可转化为手术治疗。这提示,诱导免疫治疗可使部分不可手术患者转化为可手术患者,而且,可手术和放化疗患者的1年EFS率分别为74.4%和55.9%。研究公布后得到了同行的高度评价,在“灰色地带”的研究可能引发治疗模式的新改变。
晚期NSCLC——免疫治疗
11月10日,FDA批准tremelimumab联合
III期PERLA研究探索了Dostarlimab+化疗对比帕博利珠单抗+化疗用于晚期NSCLC的疗效。2022 ESMO IO大会上公布的结果显示,新药Dostarlimab数值上似乎更好,但无统计学差异。CTONG1901研究比较了
近期,ASCO指南更新指出,对于无
晚期NSCLC——靶向治疗:KRAS
12月12日,FDA加速批准adagrasib用于既往至少接受过一次全身治疗的KRASG12C突变局部晚期或转移性NSCLC。目前,KRAS抑制剂有两种药物可及。提及KRAS靶向治疗未来的发展,吴一龙教授指出,全球范围内在KRAS领域,研究者正在利用非常多的手段对KRAS靶点发起总攻,未来,KRAS靶点的突破将成为又一利器,会引发治疗模式的进一步改变。
2022 ASCO大会上一项汇总分析显示,对于KRAS突变患者,免疫联合化疗疗效优于单用免疫或化疗,研究提示,关于KRAS靶向治疗的临床研究,应将免疫联合化疗作为对照组。而2022 ESMO IO大会上,有一项研究探索了adagrasib+帕博利珠单抗一线无化疗方案用于KRAS突变NSCLC患者的疗效。结果显示,ORR为49%,而TPS>50%患者的ORR为59%,TPS 1-49%患者的ORR为48%,TPS<1%患者ORR为30%。但另一项研究结果不尽人意。吴一龙教授指出KRAS G12C突变面临的挑战包括:复杂的耐药机制、疗效尚不尽人意、最佳剂量、脑转移、其他KRAS突变等。
重要的具有影响力的研究
靶向治疗
2022年ESMO大会上公布的INSIGHT2研究,探索了
对于第三代EGFR TKI,目前有5种药物公布的中位PFS结果相当,在20个月左右,吴一龙教授认为这似乎是一座大山,是EGFR TKI面临的瓶颈。
免疫治疗
吴一龙教授指出,2022年很有看点的研究进展是免疫治疗用于EGFR TKI进展的EGFR突变患者的研究。CheckMate 722是非常值得期待的一项研究,但2022 ESMO ASIA大会上公布的结果令人失望。而由
小细胞肺癌
由
放疗的远隔效应
2022年1月在Lancet Oncology杂志发表的一项研究显示,免疫治疗耐药后放疗+免疫治疗疗效不佳而提前终止,放疗远隔效应需要更多思考和探索。
年度关键词
MRD:从1989年开始MRD开始不断有研究涌现,而近两年MRD领域进展迅速。MRD可以让我们选择合适的患者并给予适当的治疗,这一定程度上实现了临床医生的“梦想”。
CheckMate 816:是可手术肺癌新辅助治疗的新高度。该研究引起了外科领域的一系列改变,具有深远影响。
KRAS:不到1年时间内,FDA批准了两种药物的上市。而KRAS引领的不同治疗模式正峰涌而来。
总结
2022年是监管部门批准肺癌治疗药物最多的一年
MRD正加速进入临床
围术期免疫治疗是最大热点
重新定义3期肺癌治疗模式,但需要更多研究
少见靶点治疗越来越受到重视(KRAS...)
 纵隔大细胞神经内分泌癌1例CT影像
纵隔大细胞神经内分泌癌1例CT影像  张力性纵隔气肿影像表现及严重度分级
张力性纵隔气肿影像表现及严重度分级  迅速增大的肺部结节,首先考虑良性,确诊需要肺穿
迅速增大的肺部结节,首先考虑良性,确诊需要肺穿  肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!
肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!  肺段与肺内管道应用解剖
肺段与肺内管道应用解剖  肺转移瘤的十种不典型CT表现
肺转移瘤的十种不典型CT表现  肺内淋巴结的CT表现特点及与病理对照
肺内淋巴结的CT表现特点及与病理对照  肺实变与肺不张的CT鉴别诊断
肺实变与肺不张的CT鉴别诊断  医生现身说法,这五种忙帮不得!
医生现身说法,这五种忙帮不得!  北大教授:要真正让医务人员有阳光体面的收入!医
北大教授:要真正让医务人员有阳光体面的收入!医  为值夜班的医生护士鼓与呼:请给我们更多关注!
为值夜班的医生护士鼓与呼:请给我们更多关注!  广东拟取消医院用药数量限制,满足患者多样性需求
广东拟取消医院用药数量限制,满足患者多样性需求  博士、硕士入职就给精装房!又有医院不惜下血本招
博士、硕士入职就给精装房!又有医院不惜下血本招  历时7年之久,温医生宣判无罪!
历时7年之久,温医生宣判无罪!  重磅!四川发文:严禁限制医生多点执业
重磅!四川发文:严禁限制医生多点执业  与真人医生诊断一致性达96%:AI医生应用前景广阔
与真人医生诊断一致性达96%:AI医生应用前景广阔