作者:杨小芳,于大海,黄腾,赵迪等,南京中医药大学附属医院放疗科
子宫颈浸润性复层产黏液性癌(ISMC)是近年来发现的一种具有特殊组织学类型的浸润性肿瘤[1-2],临床上较为罕见,临床医师对其缺乏充分认识。本文通过分析2例子宫颈ISMC患者的临床诊疗过程及回顾相关文献,以期提高临床医师对该病的认识。
1病历摘要
例1.患者57岁,因“绝经后阴道不规则流血1年”于2020年2月13日就诊南京中医药大学附属医院。妇科检查:子宫颈下唇见糜烂样改变,直径约1cm,宫旁组织及双侧附件区未见明显异常。外院阴道镜下子宫颈组织病理活检提示:鳞状上皮高级别上皮内病变伴腺体累及,部分呈早期浸润性鳞状细胞癌。本院病理会诊提示:子宫颈上皮内瘤变(CIN)Ⅲ级,累及腺体,部分癌变及浸润。盆腔MRI提示子宫颈异常强化灶,人乳头瘤状病毒(HPV)18阳性,鳞癌相关抗原(SCC)未见明显异常。行经腹广泛性子宫+双附件切除+盆腔淋巴结切除术,术后病理提示复层产黏液上皮内病变(SMILE),小灶间质见ISMC浸润(浸润深度1mm),未见脉管癌栓及神经侵犯,盆腔淋巴结切除未见转移,癌组织未见残留。免疫组化:CK7(+),p40(-),p63(弱+),CK5/6(-),p16(+),Ki67(10%+),ER(-),PR(弱+),Pax-8(-),p53(局灶+)。病理诊断为子宫颈腺癌(SMILE,pT1a1 N0 cM0,IA1,AJCC分期8th)。术后随访10个月,阴道残端见一菜花样肿物,直径约1cm,病理活检提示ISMC。免疫组化:CK7(+++),CEA(++),p16(+++),p40(-),CK5/6(-),p53(散在+),Ki67(50%)。行阴道切除术,术后病理提示ISMC(浸润最深处0.9mm),周围见原位腺癌。免疫组化:p16(+++),p63(-),CK5/6(-),Ki67(约40%)。术后化疗4周期,具体方案:紫杉醇注射液135mg/m2d1+卡铂注射液AUC5,d2。目前辅助化疗结束,随诊中。
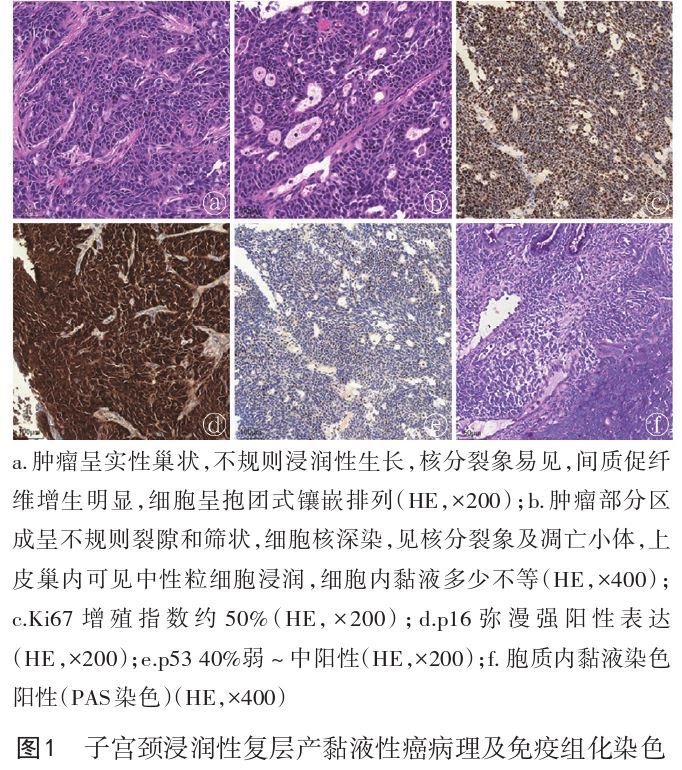
例2.患者51岁,因“绝经后阴道不规则流血2个月”于2020年8月5日就诊本院。妇科检查:阴道前壁质地偏硬,子宫颈见一菜花样肿物,直径约5cm,表面无破溃,左侧宫旁增厚,累及盆壁,右侧宫旁增厚,宫体可扪及质硬包块按之轻压痛。全腹CT及盆腔MRI提示子宫颈癌,边界不清,侵犯宫底、宫体、阴道及膀胱,双侧附件转移,盆腔内多发淋巴结转移。阴道镜下行子宫颈组织活检,病理提示低分化癌(见图1a、1b),周围可见SMILE。免疫组化:CK7(++),CK20(-),p40(局灶+),p63(局灶+),CK5/6(局灶+),Ki67(约50%+)(见图1c),p16(弥漫+)(见图1d),癌胚抗原(CEA)(+),ER(-),PR(30%弱+),Pax-8(-),p53(40%弱~中+)(见图1e),WT-1(-),AB-PAS(散在+)(见图1f)。CEA71.64μg/L,糖类抗原125(CA125)491.40 kU/L,SCC1.8μg/L,HPV18型阳性,骨显像、胸部CT未见明显异常。临床诊断:子宫颈浸润性复层产黏液性癌(ⅢC1r期,2018FIGO分期)。
治疗方案:先行新辅助化疗,后行同步放化疗。新辅助化疗的具体方案:4个周期TP方案,即紫杉醇脂质体135mg/m2d1+顺铂25mg/m2,d1~3。新辅助化疗后,复查盆腔磁共振提示部分缓解,后序贯同步放化疗。同步放疗采取盆腔外照射加腔内照射,盆腔外照射采取同步加量调强放疗技术(SIB-IMRT),临床靶区(CTV)包括子宫颈肿块、子宫、附件、宫旁,髂血管旁、部分骶前、闭孔淋巴引流区、膀胱后壁及阴道上2/3,Dt:1.8Gy/f,5f/w,共48.6 Gy/27f;GTVnd包括转移淋巴结,Dt:2.2Gy/f,5f/w,共59.4Gy/27f;后行4次腔内照射,6Gy/f,1f/w,A点剂量24Gy/4f。同步化疗方案同新辅助化疗方案。治疗结束后PET-CT未见活肿瘤病灶残留,疗效评价临床完全缓解。目前已随访6个月,未见复发和转移。
2讨论
ISMC是具有独特组织学类型的浸润性癌,在2016年由Lastra等[1]报道并命名。2018年的国际子宫颈腺癌标准和分类(International Endocervical Aden-ocarcinoma Crite⁃ria and Classificati-on,IECC)根据与病因学相关的形态学特征将子宫颈ISMC归为HPV相关黏液型腺癌[3]。
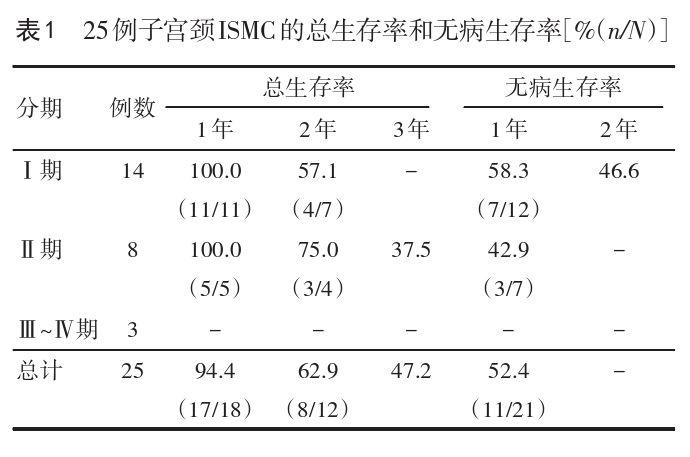
SMILE是不同于高级别鳞状上皮内病变和普通型原位腺癌的另一种特殊类型的子宫颈原位肿瘤,在2000年由Park等[4]首次报道。在2014年的女性生殖器官肿瘤WHO分类中,明确将其归类为子宫颈原位腺癌[5]。有文献认为,子宫颈ISMC和SMILE都是来源于子宫颈转化区储备细胞的罕见病变[2,4],组织学上均表现为肿瘤细胞实性巢团状,癌巢中弥漫性分布产黏液细胞等特征,均与高危型HPV感染有关,而且两者在年龄上符合子宫颈原位腺癌发展为浸润性腺癌的进展历程,所以认为子宫颈ISMC可能是SMILE的浸润形式[1-2]。治疗及预后方面,在现有文献报道中,大部分病例分期较早,治疗上予根治性手术切除,加或不加术后辅助治疗(放疗或化疗或同步放化疗),但是仍然有部分病例在治疗后短期随访过程中出现盆腔复发或远处转移(肺、输尿管)或两者同时出现,严重者死亡[5-18]。在现有的数据中,32例子宫颈ISMC有随访资料[1-2,6-8,11-16],其中25例分期明确[1-2,6-7,11-13,15-16](Ⅰ期患者14例[2,6-7,11,13,15-16],Ⅱ期8例[1-2,7,12-13],Ⅲ期2例[16],Ⅳ期1例[1])。总体来说,治疗后随访1年的总生存率为94.4%,无病生存率为52.4%,5例患者仅出现盆腔复发[7,15],2例患者仅发生远处转移(均为肺转移)[1,15],2例患者同时出现局部复发和远处转移(肺、腹股沟淋巴结)[7],1例患者因快速发生腹水而死亡[1];治疗后随访2年的总生存率为62.9%,4例患者死亡[7,15],1例患者发生远处转移(输卵管转移)[6];治疗后随访3年的总生存率为47.2%,1例患者死亡[7]。进一步根据分期进行分层发现Ⅰ期患者1年、2年的总生存率分别为100%、57.1%;无病生存率分别为58.3%、46.6%。Ⅱ期患者1年、2年、3年的总生存率为100.0%、75.0%、37.5%,1年的无病生存率是42.9%。Ⅲ、Ⅳ期患者较少,未进行分析。见表1。由于子宫颈ISMC的案例报道有限,其随访时间也长短不一,以上结果可能存在较大偏差,需要未来继续积累数据进行分析。
本组病例1术前子宫颈活检提示CINⅢ级,部分癌变,未行免疫组化检查,而ISMC和SMILE细胞核具有非典型性,其确诊必须依据免疫组化检查,因此会出现术前术后病理不一致的情况。又因术前活检取材较浅,故术前活检的病理浸润深度未能真实反应实际浸润深度,因此行根治性手术,但效果欠佳,术后10个月出现局部复发,且复发后病理类型为ISMC,较初诊时病理恶性程度更高,复发后进行再次手术和化疗,目前辅助化疗结束,随诊中。病例2的分期较晚,根据NCCN指南,原则上应初诊时行根治性同步放化疗,但考虑到肿块较大,侵犯范围较广(已侵犯全子宫及附件),若初诊时行放疗,靶区过大,患者无法耐受,经全院多学科诊疗模式(MDT)讨论后,先行新辅助化疗缩小肿块,后行同步放化疗。经4周期新辅助化疗和同步放化疗后,达临床缓解,未来还需密切随访其远期疗效、无病生存期、总生存期等指标,这能为局部晚期、不可手术切除的子宫颈ISMC的治疗提供参考依据。
为此,我们应该思考,对于能手术切除的子宫颈ISMC是否需要扩大手术切除范围,以减少局部复发?对于子宫颈ISMC这种特殊类型的子宫颈癌,在行根治性子宫切除术后,虽然无盆腔淋巴结转移、切缘阳性、宫旁浸润、脉管癌栓等常见危险因素,但是由于其组织学类型的特殊性,术后是否需要继续追加辅助治疗(如辅助放疗或化疗)?对于初诊肿块较大、浸润范围较广泛、无法行根治性手术或根治性放疗的患者,能否通过新辅助化疗将肿块缩小,将原本无法手术或放疗的病例变成能进行手术或放疗的病例?近年来,免疫检查点抑制剂和靶向治疗为肿瘤治疗提供了新的手段。KEYNOTE-028和KEYNOTE-158研究证实了帕博丽珠单抗在治疗晚期子宫颈癌方面取得了一定的疗效[19-22]。因此,我们应该思考对于这种特殊类型的子宫颈癌,能否在检测PD-L1、TMB、MSI的表达后,有选择的将免疫检查点抑制剂提前引入ISMC的治疗中?能否在根治性放化疗阶段提前加入抗血管生成药物?这些有可能为该类型的子宫颈癌患者带来新的曙光。但目前尚未有大样本的数据验证这种假说。
总之,基于文献和我们观察的有限数据,与其他类型的子宫颈癌相比,子宫颈ISMC的恶性程度较高,侵袭性较强,较快出现复发和转移,预后较差[7,23]。目前,各国指南均未对这一特殊类型肿瘤提出特殊的治疗策略。因此,有效的治疗措施需要进一步探索。此外,对于此类特殊类型的子宫颈癌,在治疗后要密切随访。
参考文献略。
来源:杨小芳,于大海,黄腾,赵迪等,子宫颈浸润性复层产黏液性癌诊疗分析及文献回顾[J].中国实用妇科与产科杂志,2022,38(02):254-256.
 纵隔大细胞神经内分泌癌1例CT影像
纵隔大细胞神经内分泌癌1例CT影像  张力性纵隔气肿影像表现及严重度分级
张力性纵隔气肿影像表现及严重度分级  迅速增大的肺部结节,首先考虑良性,确诊需要肺穿
迅速增大的肺部结节,首先考虑良性,确诊需要肺穿  肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!
肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!  肺段与肺内管道应用解剖
肺段与肺内管道应用解剖  肺转移瘤的十种不典型CT表现
肺转移瘤的十种不典型CT表现  肺内淋巴结的CT表现特点及与病理对照
肺内淋巴结的CT表现特点及与病理对照  肺实变与肺不张的CT鉴别诊断
肺实变与肺不张的CT鉴别诊断  医生现身说法,这五种忙帮不得!
医生现身说法,这五种忙帮不得!  北大教授:要真正让医务人员有阳光体面的收入!医
北大教授:要真正让医务人员有阳光体面的收入!医  为值夜班的医生护士鼓与呼:请给我们更多关注!
为值夜班的医生护士鼓与呼:请给我们更多关注!  广东拟取消医院用药数量限制,满足患者多样性需求
广东拟取消医院用药数量限制,满足患者多样性需求  博士、硕士入职就给精装房!又有医院不惜下血本招
博士、硕士入职就给精装房!又有医院不惜下血本招  历时7年之久,温医生宣判无罪!
历时7年之久,温医生宣判无罪!  重磅!四川发文:严禁限制医生多点执业
重磅!四川发文:严禁限制医生多点执业  与真人医生诊断一致性达96%:AI医生应用前景广阔
与真人医生诊断一致性达96%:AI医生应用前景广阔