作者:胡明静,王志勇,南京市口腔医院口腔颌面外科
1.病例
患者,男,18岁,因右下颌无痛性肿大9个月于2020年7月来本院就诊。患者2019年10月发现右下颌骨膨隆,近9个月病变缓慢增大,无疼痛不适,CT提示右下颌骨不规则低密度影。否认外伤病史。否认家族遗传病病史。
1.1查体
颌面部不对称,右下颌角区见膨隆,表面皮肤颜色正常。44~47叩痛(-),无松动。45远中至右下颌骨升支前缘颊侧可扪及颌骨膨隆,范围约4cm×3cm,界限不清,质硬,未扪及乒乓球样感,无明显触压痛(图1a)。
1.2下颌骨螺旋CT检查
右下颌骨体部见类圆形膨胀性混杂密度影,其间可见软组织密度影及散在不规则斑点片状骨化影,周壁硬化,未见囊性密度影,轴位最大切面积为4.5cm×2.6cm(图1b~1f)。
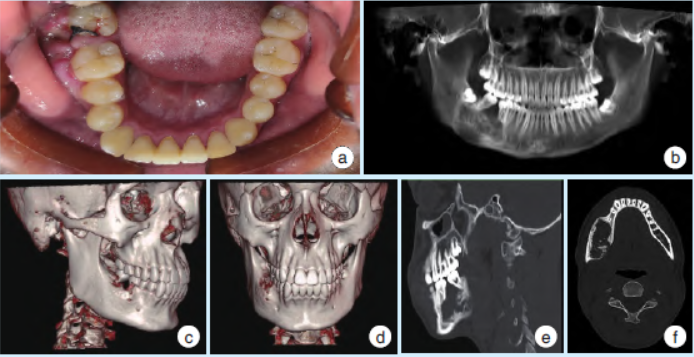
图1右下颌骨促结缔组织增生性纤维瘤术前影像资料
1.3诊断与治疗
入院后局麻下取材活检,明确诊断为右下颌骨促结缔组织增生性纤维瘤。术前采用数字化设计(图2a)结合3D打印技术制备下颌骨截骨导板、腓骨塑形导板以及下颌骨修复后模型,完成重建钛板的个体化预弯制。排除手术禁忌后于全麻下行右下颌骨病变切除术+右下颌骨节段性切除术+左腓骨肌皮瓣转移修复术+钛板钛钉植入术(图2b~2d)。
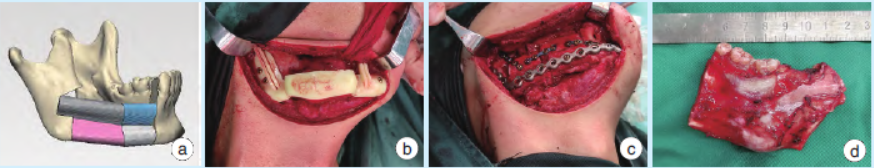
图2右下颌骨促结缔组织增生性纤维瘤术中照
1.4术后病理
组织
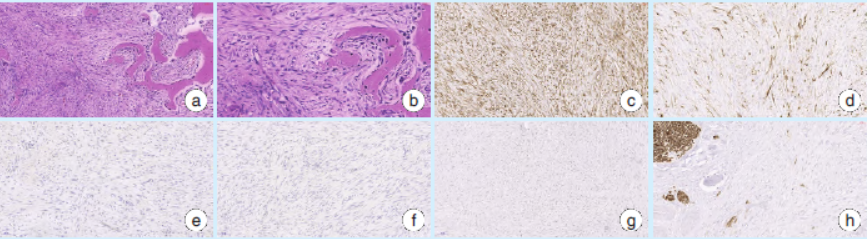
图3右下颌骨促结缔组织增生性纤维瘤组织病理和免疫组化染色结果
1.5结果
术后患者外形恢复良好,咬合关系和髁突位置较术前无明显变化(图4a)。术后7月螺旋CT复查见腓骨各段、腓骨与下颌骨残端间出现骨愈合影像(图4b)。随访1年,未见复发。
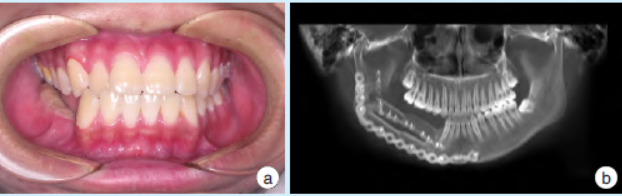
图4右下颌骨促结缔组织增生性纤维瘤术后影像资料
2.讨论
DMPF的发病率约为所有原发性骨肿瘤的0.1%。DMPF可累及任何骨骼,但最常见于下颌骨(22%),其次是股骨(15%)、骨盆骨(13%)、桡骨(12%)和胫骨(9%)。约84%的颌骨DMPF患者年龄在30岁以下,平均年龄为16岁。女性稍多于男性。
DMPF病因尚不明确,目前认为与内分泌、创伤和遗传变异等因素相关,但具体发病机制未明。部分DMPF存在8号染色体三体畸形和20号染色体非选择性畸变、CTNNB1基因点突变及APC基因突变情况。此外,颌骨DMPF可能是结节性硬化病的口腔表现之一。本组患者均否认外伤病史及遗传病史,同时全身未查及系统性疾病。DMPF临床表现与其他纤维骨性病变相似。病变早期大多数患者无症状,少数患者病变区域或周边部位疼痛致张口受限;伴或不伴咬合紊乱,牙松动移位。
病变过大时常致面部畸形,咬合功能障碍。本组病例中病变较小者多无症状,因检查摄片发现颌骨内低密度影就诊。而病变较大患者多出现软组织膨隆,面形改变伴疼痛不适而就诊。DMPF影像学表现亦无特异性,CT常表现为溶骨性、膨胀性骨破坏,形成界限清楚或不规则的单房或多房透光性病变,病变内骨小梁可形成分叶状,内部偶见散在不规则点片状骨化影,周缘可伴不同程度的边缘硬化。累及骨皮质时呈虫蚀状吸收,骨膜成骨征象少见。DMPF可摄取氟代脱氧
MRI上,病变在T1加权图像为均匀等信号,T2加权图像上呈现为低或中信号强度,增强后肿瘤呈现不均匀的增强,其他部位无或轻度增强。与MRI相比,CT能更好地显示骨破坏程度,而MRI能更好地描述肿瘤的骨髓和软组织侵犯范围。如果怀疑骨质破坏,应进行CT扫描以更好地显示骨骼结构并量化骨破坏程度。
如果怀疑肿瘤侵犯软组织,建议首选MRI检查。借助临床及影像学表现通常无法诊断该疾病,现仍依靠组织病理学诊断。镜下见增生的纤维母细胞和胶原纤维呈束状、编织状排列。细胞核无明显异型性,核分裂像少见。病灶中心缺乏骨及软骨成分,肿瘤与周围骨质交界处可见残留骨组织。肿瘤组织无包膜,浸润性生长,可侵及周围软组织,但组织学分化良好,无恶性改变。
根据DMPF缺乏核多形性,核分裂活性低,缺乏牙源性上皮细胞,缺乏牙骨质或骨成分这些组织病理学特征有助于鉴别DMPF与其他颌骨病变。本组病例形态均较为典型,依靠HE染色可做出正确诊断。自1991年以来,多种免疫组化标记物用于DMPF的鉴别诊断,如S100、SMA、Vimentin、Ki-67、β-atenin等。本组病例中Vimentin常为强阳性,S-100阴性,提示该病起源于间叶组织,与文献报道相符合。
大部分患者α-MA表现为细胞质内散在阳性。增殖标志物Ki-67在DMPF中表达较低。本组病例中2例复发患者Ki-67增高,提示复发后肿瘤侵袭性增强,再次复发概率大。DMPF中β-atenin多表达于细胞质,部分表达于细胞核。本组病例中β-atenin细胞质阳性例数5例,强弱程度不等,细胞核阳性例数1例,细胞核阴性例数2例,与Kahraman等研究结果相似。目前为止,还没有可靠的用于诊断DMPF的免疫组化标记物。
DMPF的病理表现常需与以下疾病鉴别。
①软组织韧带样纤维瘤病:发生于软组织,累及骨骼时,其形态学与累及软组织的DMPF难以区分。软组织韧带样纤维瘤病累及骨骼时常表现为压迫性侵袭与浅表皮质缺损;而DMPF主体病灶在骨内,累及软组织时常见病变骨膨胀,相应骨皮质吸收破坏,软组织肿块边界相对清楚。这两者间主要依靠临床病史中病变发展过程及影像学表现鉴别。此外,软组织韧带样纤维瘤病因β-atenin或APC基因突变,导致β-atenin核内堆积。而DMPF中β-atenin多表达于细胞质,因此,这提示软组织韧带样纤维瘤与DMPF发病机制、免疫表型不同;β-atenin细胞核染色阴性可以有助于鉴别软组织纤维瘤病,但不是明确诊断DMPF的必要条件。
②纤维结构不良(fibrous dysplasia,FD):当FD以纤维组织为主而骨化不明显时,二者常难以区分,但FD无细胞异型性,可见小梁状编织骨,成骨区较DMPF明显。偶有报道,当FD显示为局部侵袭性时,可伴发促结缔组织纤维瘤样变。
③低度恶性纤维肉瘤:其瘤细胞常排列成特征性鲱鱼骨样结构,细胞丰富,异型性明显,易见核分裂像;而DMPF病变内细胞数量少,异型性、多形性或有丝分裂较少。
④低级别骨肉瘤:组织学表现与促纤维增生性纤维瘤相似,肿瘤组织存在轻度不典型和少量核分裂,但缺乏普通型骨肉瘤的细胞多形性。依靠MDM2/CDK4表达呈阳性,可与良性纤维骨性病变相鉴别。
当纤维骨性病变无法从组织病理学上区分时,可通过核型分析和分子遗传学分析来辅助诊断,部分DMPF存在CTNNB1和APC突变,FD常有GNAS基因突变,而低级别骨肉瘤常有MDM2基因扩增,低度恶性纤维肉瘤见FUS-CREB3L2融合基因。DMPF具有侵袭性,通常采用扩大切除手术进行治疗。文献报道,采用扩大切除的患者无复发;而采用单纯病变切除或摘除治疗的复发率为20%~40%;而仅仅只是刮治疗法的复发率高达70%。
本组病例中3例初发患者采用扩大切除术,3例初发患者采用刮除术,该6例初发患者随访至今均无复发,但仍需长期随访。本组病例中2例复发患者首次治疗均采用刮治术。考虑到切除不干净术后复发可能性,初次治疗应尽量采取扩大切除术。对复发病例的治疗主要是广泛切除。对于部分患者无法行手术治疗或手术中无法切除干净病灶,术后行放疗可降低复发率。
部分患者在使用
综上所述,DMPF推荐的治疗策略是扩大切除,减少复发风险。
来源:胡明静,王志勇.颌骨促结缔组织增生性纤维瘤8例临床分析[J].口腔疾病防治,2022,30(08):571-577.
 纵隔大细胞神经内分泌癌1例CT影像
纵隔大细胞神经内分泌癌1例CT影像  张力性纵隔气肿影像表现及严重度分级
张力性纵隔气肿影像表现及严重度分级  迅速增大的肺部结节,首先考虑良性,确诊需要肺穿
迅速增大的肺部结节,首先考虑良性,确诊需要肺穿  肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!
肺隔离症:易误诊为肺癌的占位性病变,肺穿刺禁忌!  肺段与肺内管道应用解剖
肺段与肺内管道应用解剖  肺转移瘤的十种不典型CT表现
肺转移瘤的十种不典型CT表现  肺内淋巴结的CT表现特点及与病理对照
肺内淋巴结的CT表现特点及与病理对照  肺实变与肺不张的CT鉴别诊断
肺实变与肺不张的CT鉴别诊断  医生现身说法,这五种忙帮不得!
医生现身说法,这五种忙帮不得!  北大教授:要真正让医务人员有阳光体面的收入!医
北大教授:要真正让医务人员有阳光体面的收入!医  为值夜班的医生护士鼓与呼:请给我们更多关注!
为值夜班的医生护士鼓与呼:请给我们更多关注!  广东拟取消医院用药数量限制,满足患者多样性需求
广东拟取消医院用药数量限制,满足患者多样性需求  博士、硕士入职就给精装房!又有医院不惜下血本招
博士、硕士入职就给精装房!又有医院不惜下血本招  历时7年之久,温医生宣判无罪!
历时7年之久,温医生宣判无罪!  重磅!四川发文:严禁限制医生多点执业
重磅!四川发文:严禁限制医生多点执业  与真人医生诊断一致性达96%:AI医生应用前景广阔
与真人医生诊断一致性达96%:AI医生应用前景广阔 
